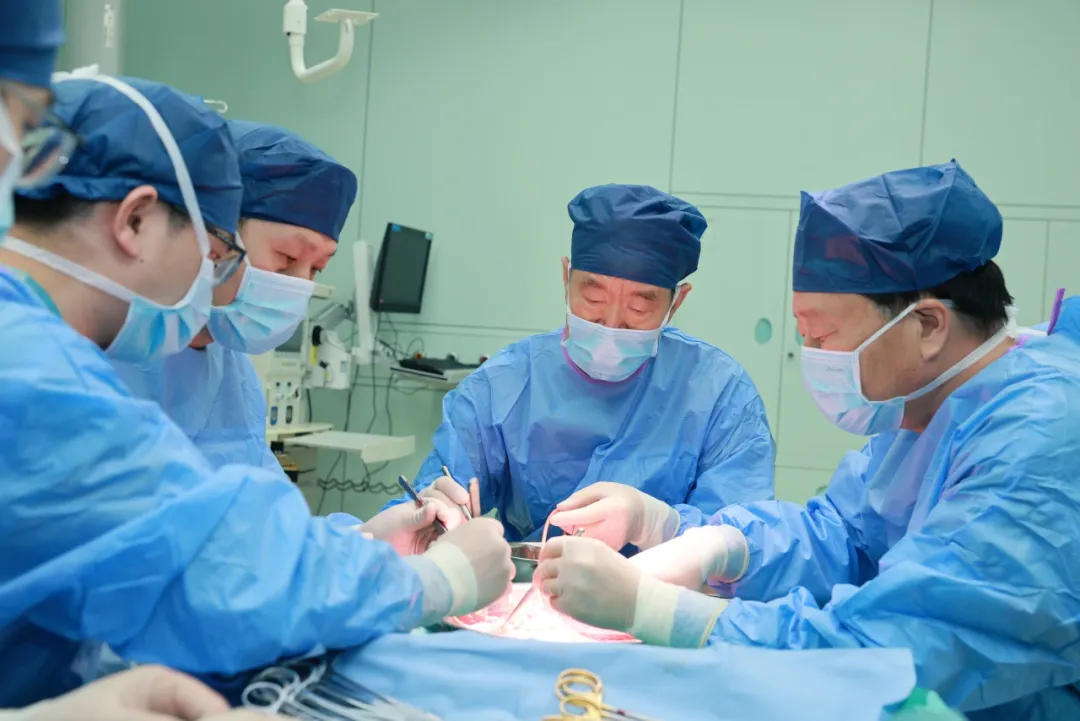
美國腦機介面公司Paradromics近日宣佈,其腦機介面(BCI)已獲美國食品和藥物管理局(FDA)批准開展首個長期臨床試驗。
據《自然》報導,明年初,作為美國企業家埃隆·馬斯克旗下腦機介面公司Neuralink的最大競爭對手之一,Paradromics將為兩名因神經系統疾病或意外傷害而喪失語言能力的志願者植入BCI。試驗有兩大目標:一是確保設備安全,二是恢復患者的即時語音交流能力。
Paradromics的BCI擁有直徑約7.5毫米的有效區域,內置纖細且堅硬的鉑銥合金電極。當這些電極穿透大腦皮層表面時,可記錄約1.5毫米深處單個神經元的活動。電極通過導線與植入患者胸部的電源和無線收發器連接。
Paradromics首席執行官Matt Angle表示,這是首個以合成語音生成為目標的BCI臨床試驗。“可以說,目前BCI能為患者生活品質帶來的最大改變,就是恢復其語音交流能力。”
該試驗還將探索能否精准檢測志願者想像手部運動時的神經活動,從而讓他們可以通過意念控制電腦游標。根據初步結果,該試驗可能擴展至10名志願者,他們將接受兩個大腦皮層植入物,以增加信號豐富度並覆蓋更多腦區。
“我對此非常好奇,這是令人振奮的一步。”荷蘭烏得勒支大學醫學中心的Mariska Vansteensel說。
除了Paradromics,目前在BCI方面進展較快的還有美國公司Synchron。其設備Stentrode基於血管內支架,內置12至16個電極,可從血管內部記錄神經元群體的活動。而Neuralink則優先通過記錄大量單個神經元的輸出信號來獲取高帶寬數據。其BCI包含64根柔性聚合物線,每根線設有16個記錄位點。
各公司均致力於讓植入過程微創、設備可更換。Angle表示,在此次試驗中,Paradromics “將在安全性、耐用性和數據傳輸速率方面同時發力”。“該設備實現的腦外資訊傳輸速率約為其他設備的20倍,並且我們認為該設備的使用壽命應超過10年。”
隨著長期臨床試驗的推進,臨床醫生和神經科學家將密切關注並對比各設備的效果。Vansteensel表示,希望各公司能保持完全透明,向學術界開放設備,以便其開展獨立研究。
來源:中國澎湃新聞









 您當前的位置 :
您當前的位置 :