2月17日消息,大家知道,核輻射等高劑量輻射會擊碎人體細胞內的DNA,一般是通過物理遮罩、抗氧化劑進行防護,但卻無法阻止輻射引發的正常組織程式性細胞死亡。
電離輻射造成的DNA損傷,會導致腸道細胞大規模凋亡,進而出現嚴重胃腸道綜合症(GIS),導致腸黏膜脫落、出血甚至多器官衰竭,目前尚無特效藥物。
近日,中國科學院廣州生物醫藥與健康研究院首次證實,干擾素基因刺激因數(STING)蛋白可以通過一個全新的路徑(PARP1-PAR-STING),直接決定細胞的生死。
研究人員通過系列實驗,首次揭示了STING蛋白在DNA損傷修復中的全新作用機制。
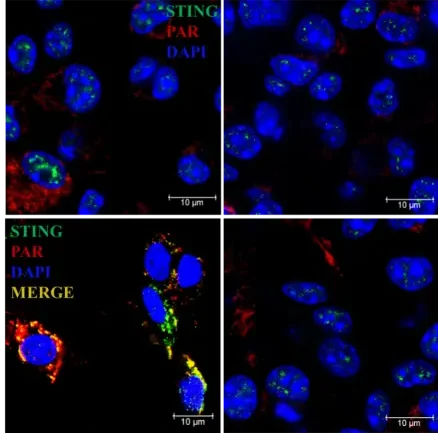
研究發現,當細胞發生DNA損傷時,DNA損傷回應蛋白PARP1會合成一種名為PAR(多聚二磷酸腺苷核糖)的聚合物。
這種PAR聚合物能夠直接與STING蛋白結合,形成“PAR-STING複合體”,從而放大DNA損傷信號,並啟動細胞凋亡程式。
為了驗證這一發現,研究人員進行了多項實驗。
首先在細胞和小鼠實驗中,使用特定劑量的PARP(聚腺苷二磷酸核糖聚合酶)抑制劑PJ34,減少80%的PAR生成,顯著降低輻射後的細胞和小鼠死亡率。
隨後,研究人員通過基因編輯技術構建了STING基因敲除的小鼠模型。
實驗發現,這些小鼠在接受腹部輻射後,存活率提高了5倍,且腸道絨毛高度是正常小鼠的2.3倍。
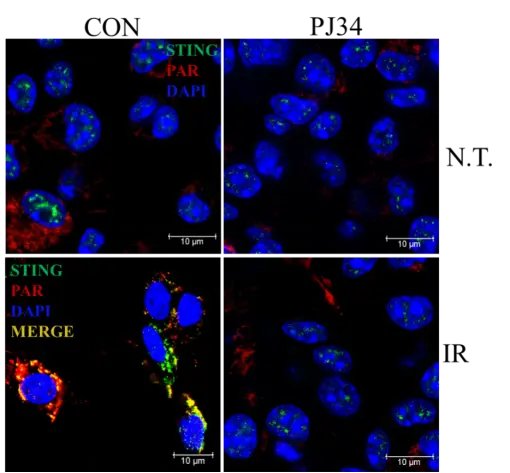
細胞實驗揭示PAR-STING的“死亡糾纏”
這項研究改變了科學界對STING蛋白的傳統認知。
過去認為,STING蛋白需要通過cGAMP分子來回應DNA損傷,但新研究發現,STING蛋白可以直接與DNA損傷時產生的高濃度PAR相互作用。
同時,研究通過多維度實驗揭示了PARP1-PAR-STING信號通路在輻射誘導凋亡中的關鍵作用,為科學家理解STING蛋白在DNA損傷回應中的作用機制提供了全新視角,為輻射損傷防護和腫瘤治療提供了重要理論依據和潛在干預靶點。
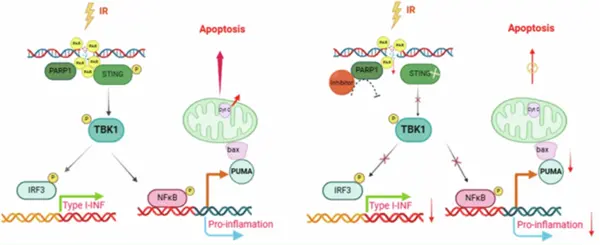
PARP1-PAR-STING介導的細胞凋亡模式圖
來源:中國快科技









 您當前的位置 :
您當前的位置 : 











