當地時間週四,美國食品藥品監督管理局(FDA)宣佈已批准瑞典醫療設備公司Flow Neuroscience的家用腦刺激設備用於治療抑鬱症,為長期使用可能產生副作用的傳統抗抑鬱藥提供了一種替代方案。
根據美國疾病控制與預防中心(CDC)的數據,美國抑鬱症發病率在過去十年中激增60%,目前影響超過2000萬成年人口。
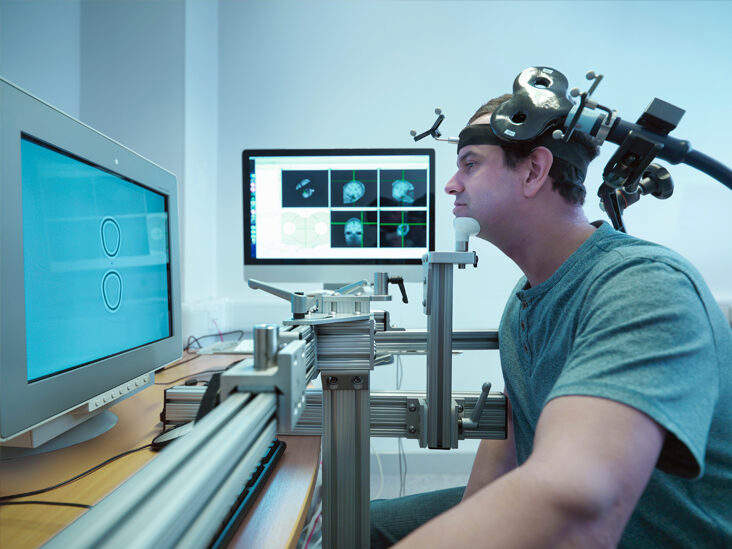
這款設備名為FL-100,重量低於一副包耳式耳機,主要向負責調節情緒的大腦區域輸送微弱電流,設計用於在遠程監督下進行家庭治療。它是美國首個獲批的同類設備。
據悉,該設備獲批用於治療中度至重度抑鬱症(MDD)的18歲及以上成年人,可作為單一療法或與其他治療方式聯合使用,但不包括那些“吃藥也沒效果”的藥物抵抗型患者。
Flow計畫在2026年第二季度以處方形式在美國上市銷售。該公司首席執行官Erin Lee表示,公司正瞄準500至800美元的零售價。Flow正與保險機構進行談判,並預計將在2026年初公佈保險報銷方案。
Lee聲稱,FDA通過其最嚴格的上市前批准(PMA) 流程批准了該設備,儘管FDA曾提議採用更寬鬆的審批途徑,但Flow主動選擇了更嚴格的方式,以增強公眾對其安全性和有效性的信心。
截至目前,該設備已在英國、瑞士、中國香港等地銷售,累計使用超5.5萬人次。
FDA的批准基於一項中期臨床研究,結果顯示58%的患者在10周治療後症狀得到緩解,其中包括許多同時接受藥物或心理治療的患者。根據公司數據,在全球用戶中,77%的用戶在三周內出現症狀改善。
患者通常需要遵循為期12周的治療方案,前3周每週進行5次治療,剩餘9周每週減少為2至3次,每次療程持續30分鐘。
Flow提到,副作用一般較輕且為暫時性,包括皮膚刺激、頭痛及電極放置部位的刺痛感。公司補充說,當電極貼片重複使用或出現乾燥時,曾發生過皮膚灼傷的情況。
儘管電刺激治療抑鬱症的有效性證據日益增多,但在美國,該技術主要局限於實驗性臨床試驗或需要患者到診所接受面對面治療的專案。
Flow獲批之際,市場對腦刺激技術的興趣明顯上升,部分原因來自馬斯克旗下的腦機介面公司Neuralink及其他致力於治療癱瘓、視力損失和精神疾病的設備開發公司。
Lee表示:“我們認為,這是精神健康治療發展歷程中的一個重要時刻。”Flow計畫進一步開展針對雙相情感障礙、創傷性腦損傷、疼痛及成癮的臨床試驗。
Flow已累計融資2200萬美元,目前正在進行新一輪融資,以支持美國市場的商業化推進。
來源:中國財聯社









 您當前的位置 :
您當前的位置 :