本網綜合網 Julie Steenhuysen and Andrew Silver 報導 日本衛材公司(Eisai)的一位發言人告訴路透社,該公司的目標是今年晚些時候在中國向1500名阿爾茨海默氏症患者推出其突破性藥物Leqembi,隨著診斷方法的改進,到2025年增長將顯著加快。
這位發言人表示,預計未來將會有更加便捷的阿爾茨海默氏症血液檢測方法,這將有助於衛材在中國約1700萬早期疾病患者中獲得更大的市場份額。
該公司的一位發言人表示:“中國是世界上老齡化速度最快的國家之一,也是阿爾茨海默病領域最重要的國家之一。Leqembi在中國有巨大的增長潛力。”
禮來公司(Eli Lilly)正在開發一種名為多奈單抗(donanemab)的類似治療藥物,該公司告訴路透社,他已在中國申請批准。這家總部位於印第安那波利斯的公司的一位發言人說,該公司目前正在中國、韓國和歐盟進行一項有1500名志願者參加的試驗。
關於衛材計畫在中國推廣的規模和禮來公司提交批准申請的情況,此前沒有報導。
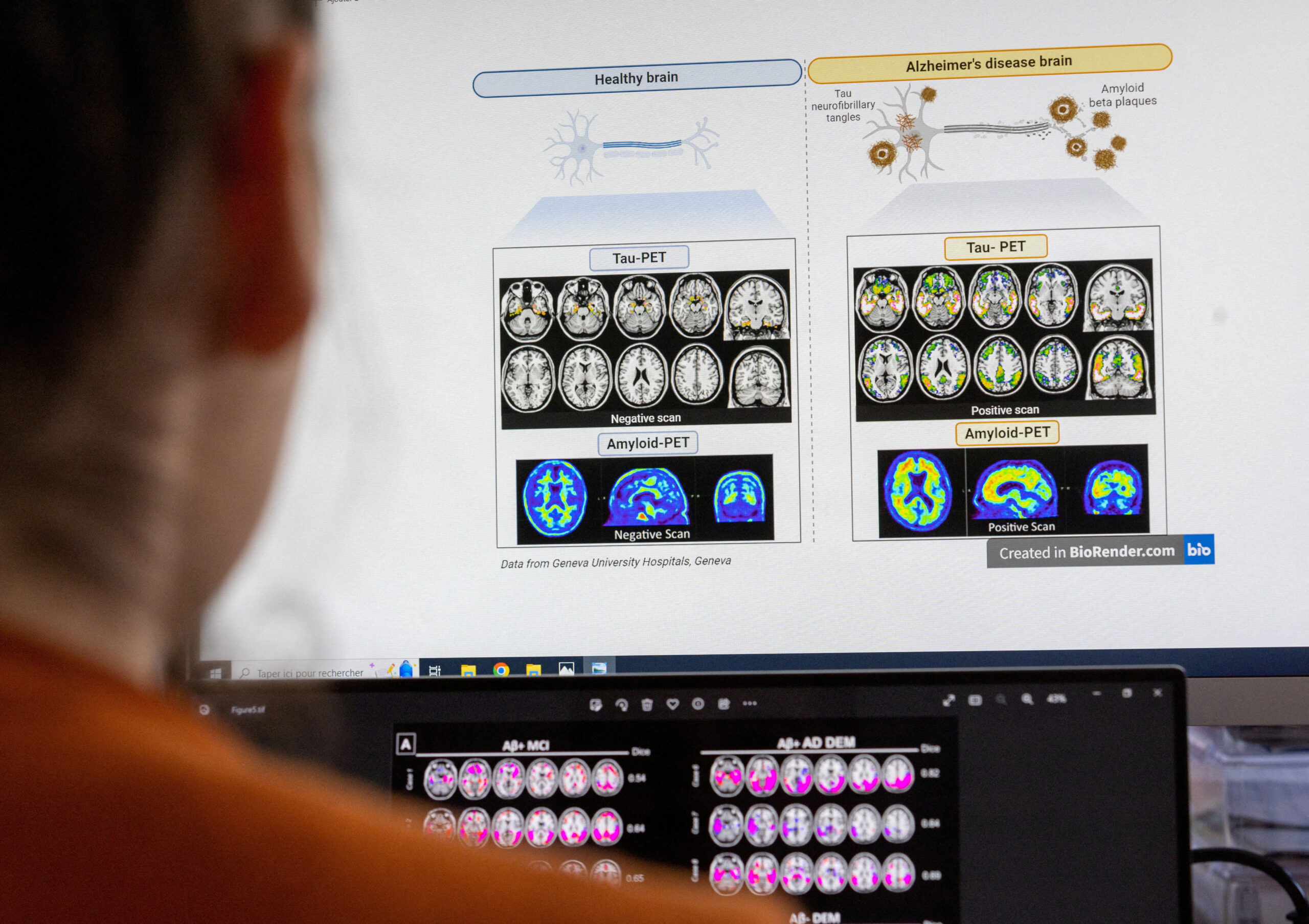
Leqembi通過清除大腦中一種名為β澱粉樣蛋白的有毒蛋白質而起作用,它是第一種被證實能改變這種致命性腦損傷疾病病程的阿爾茨海默氏症治療藥物。中國已於今年 1 月批准了 Leqembi。
衛材和美國合作夥伴百健(Biogen)已經在美國和日本推出了Leqembi,歐洲正在對其進行審查。
在一項臨床試驗中,這種每月輸注兩次的治療方法使阿爾茨海默氏症早期患者的病情惡化速度減緩了27%。
廣東醫科大學阿爾茨海默病專家劉洲博士說,中國目前的治療方法效果有限,衛材的試驗結果給患者帶來了 “很大的希望”。
衛材表示,預計將於9月開始在中國使用這種藥物,並預計到2025年3月,中國的患者總數將達到1500人,這一數字受到中國診斷能力的限制。
該公司表示,到2025年,Leqembi的銷售額可能會“大幅增長”,因為預計將引入血液測試來評估患者的澱粉樣蛋白負擔,而不是PET掃描或侵入性腰椎穿刺,這些都需要專科醫生的幫助。
花旗銀行分析師 Hidemaru Yamaguchi 在一份研究報告中說:”如果僅靠血液化驗就能進行治療,我們認為這會引起極大的興趣。他沒有對中國市場做出估計,但預計 Leqembi 在日本和美國以外地區的銷售額將在 2030 年達到峰值,達到 1,260 億日元(合 10.8 億美元)。
根據發表在《英國醫學雜誌》上的《2022 年中國阿爾茨海默病報告》,亞洲最大經濟體的阿爾茨海默病診斷和治療率仍然很低,醫學專家和公眾對這種疾病的認識也很有限。
截至發稿時,中國衛生部尚未回應置評請求。
專家表示,中國一直在提高成像能力。在中國銷售成像設備的西門子醫療集團表示,中國分子成像市場在過去四年裏增長了45%以上。
準備不足
最初,衛材計畫在中國私人市場推出Leqembi,其價格約為每年20萬元人民幣(28180美元),比美國高出約2000美元。
衛材表示,將在評估私人市場需求後再決定是否尋求政府資助。
列入中國國家報銷藥品目錄通常意味著大幅降價。2023 年的一項分析估計,平均談判降價幅度在 44% 到 61% 之間。
為了獲得治療資格,患者需要接受認知測試、基因測試,以評估他們是否攜帶會增加藥物不良副作用的基因,以及確認澱粉樣蛋白水準異常的測試。
一旦接受治療,合適的患者將接受一系列核磁共振掃描,以監測大腦中可能致命的腫脹和出血。
曾為衛材和百健提供諮詢服務的南加州大學腦健康觀察站主任、經濟學家 Soeren Mattke 博士說,中國缺乏一個由初級保健醫生進行初步檢測並將合適人選轉介給專科醫生的系統。
Mattke 及其同事於今年 7 月在《阿爾茨海默氏症與癡呆症》雜誌上發表了一份關於中國對疾病改變治療準備情況的評估報告,結論是中國 “在及時提供阿爾茨海默氏症治療方面準備不足”。
Mattke說:“在中國,農村地區幾乎沒有專科醫療”。









 您當前的位置 :
您當前的位置 : 












